TCR/BCR
レパトア解析
- TOP
- 医療従事者・研究者の皆さまへ
- 技術紹介
- TCR/BCR レパトア解析
TCR/BCR レパトア解析
非バイアス次世代 T細胞受容体(TCR)/B細胞受容体(BCR)レパトア解析
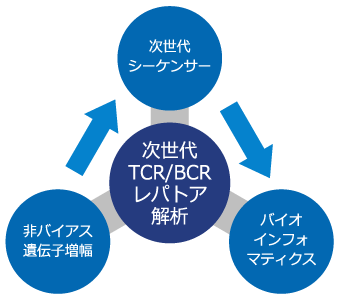
当社は非バイアス遺伝子増幅技術と独自に開発した専用バイオインフォティクスソフト(Repertoire Genesis)を備えた次世代TCR/BCRレパトア解析技術を開発いたしました。
この技術は、従来の技術に比べ定量性に優れ、悪性リンパ腫や白血病細胞の検出、抗原特異的TCR/BCRの同定、免疫チェックポイント阻害剤やがん免疫療法の有効性評価などの幅広い用途に利用することができます。
当社は、最先端技術を利用した研究を通して、新しい診断法や治療法の開発を支援してまいります。
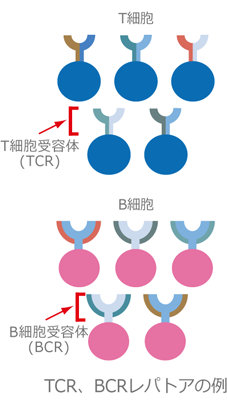
レパトアとは?
白血球は、顆粒球、樹状細胞、マクロファージ、リンパ球などから成り、それらは体内に侵入するウイルスなどの病原体や、がん化した異常細胞を排除することにより生体を防御しています。
主要なリンパ球であるT細胞とB細胞は、抗原を認識する受容体分子であるT細胞受容体(TCR)やB細胞受容体(BCR)を発現しています。がんやウイルスなどの抗原がこれら受容体に結合すると、細胞は活性化され、免疫反応を開始します。
多様な抗原と反応できるように、遺伝子再構成や体細胞超突然変異という機構によって、多様なTCRやBCRが創出されます。その程度はTCRでは10の18乗、BCRでは10の15乗におよぶと推測されています。
このように、個々に異なる特異性を持ったTCRやBCRによって、特徴づけられたリンパ球のコレクションをTCR/BCRレパトアといいます。レパトア(repertoire)は、レパートリー(repertory)と同義のフランス語です。
レパトア解析の有用性
TCR/BCRレパトア解析は、免疫系の状態や異常を知るために有用です。ある種の白血病や悪性リンパ腫の患者では、T細胞またはB細胞が腫瘍化して異常増殖するため、これらを検出することは、診断や治療効果を測るために利用できます。しかし、従来のフローサイトメトリーや免疫組織化学染色による解析は、検出感度や正確性に限界がありました。
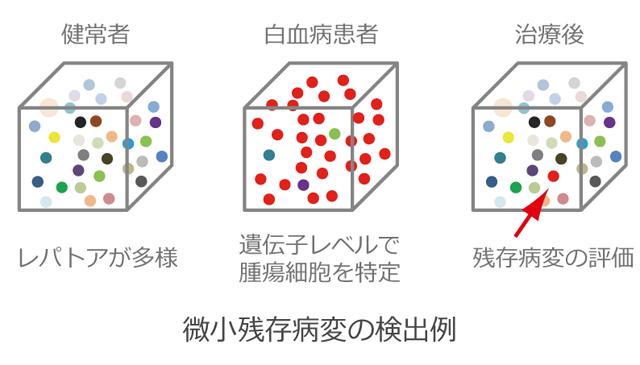
非バイアス次世代TCR/BCRレパトア解析では、測定試料から定量的に10万-1000万のTCRやBCR遺伝子配列を決定することができます。したがって、10万分の1未満(0.001%未満)の腫瘍細胞をクローンレベルで特定することができ、微小残存病変の検出にも利用することができます。
レパトア解析は、免疫系の多様性を評価するためにも有用です。免疫多様性は、ウイルスや細菌などに対する感染防御に重要ですが、これまで定量的に調べることは容易ではありませんでした。レパトア解析によって多様性の程度や変化を明らかにすることで、移植後の免疫系の回復度を予測することができます。
クローンレベルの大規模な遺伝子配列を決定することにより、抗原特異的TCR/BCR遺伝子を取得することができます。抗原刺激、ウイルス感染、疾患関連試料などの解析を行うことで、さまざまな抗原特異的TCR/BCR遺伝子を同定することに利用することができます。
主要技術
非バイアス遺伝子増幅技術 (Adaptor-ligation PCR法)
5’末端にアダプターを結合し、アダプタープライマーと3’側の定常領域に設定したプライマーを用いてPCRを行います。既存のMultiplex PCR法とは異なり、多数のプライマーの使用にともなうプライマー間の増幅効率の差によるPCRバイアスが発生せず、高精度なレパトア解析を実現します。
次世代シーケンサー (MiSeq)
PCR増幅されたTCRやBCR遺伝子を、ロングリード対応の次世代シーケンサーで配列決定します。1度の解析で10万~1000万のリードデータを取得することができます。
レパトア解析専用ソフト (Repertoire Genesis)
個々のTCR/BCRリードについて、相同性検索によるV領域、D領域、J領域遺伝子の決定、アミノ酸変換、リード数集計などを行います。大量のシーケンスデータを高速、高精度に自動処理するため専用ソフトを開発いたしました。
シングルセル解析を用いたレパトアの「ペア同定」
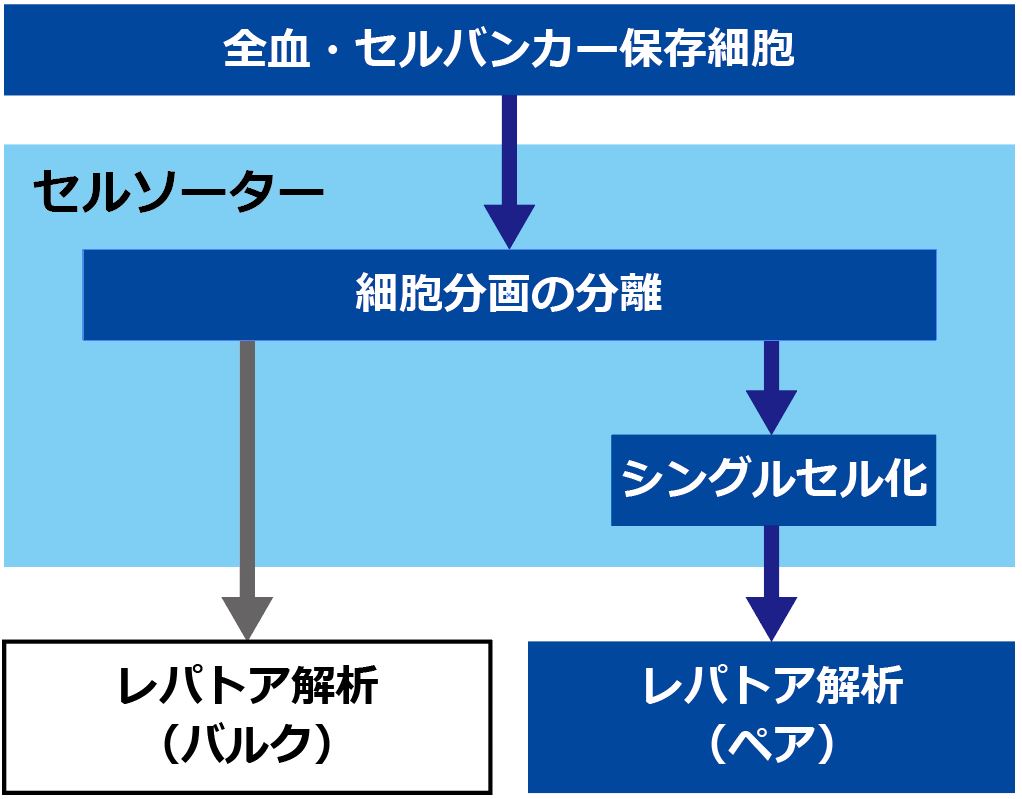
確実な「ペア」情報を得るためには、細胞をモノクローン化し、レパトア解析を実施する必要があります。
レパトア解析のシングルセル解析は、一般的なシングルセル解析と異なり、機能が限定された少数の細胞集団を対象とした解析が想定されます。
当社では、全血検体やセルバンカー保存された細胞をお預かりし、セルソーターを用いて特定の分画における効率的な「ペア同定」をご提案いたします。
適応例
悪性リンパ腫・白血病

腫瘍細胞のTCR、BCR遺伝子をクローンレベルで決定、追跡、微少残存病変の検出
感染症

- ウイルス特異的TCRの同定
- ウイルス抗原特異的抗体遺伝子の同定
免疫チェックポイント阻害薬
腫瘍浸潤T細胞のレパトア解析による治療薬の有効性評価
TCR遺伝子治療法の開発支援
腫瘍特異的TCR遺伝子を同定し、医療へ応用
骨髄移植
レパトアの多様性から免疫能回復を評価
新規 CAR-T 開発支援
有用なCAR-T作製のための抗体遺伝子の取得
がんワクチン・免疫細胞療法
- がんワクチン・免疫細胞療法の有効性評価
- 腫瘍特異的TCRの検出
抗体医薬の創薬支援
効率的な完全ヒト型抗体遺伝子のスクリーニング
技術詳細
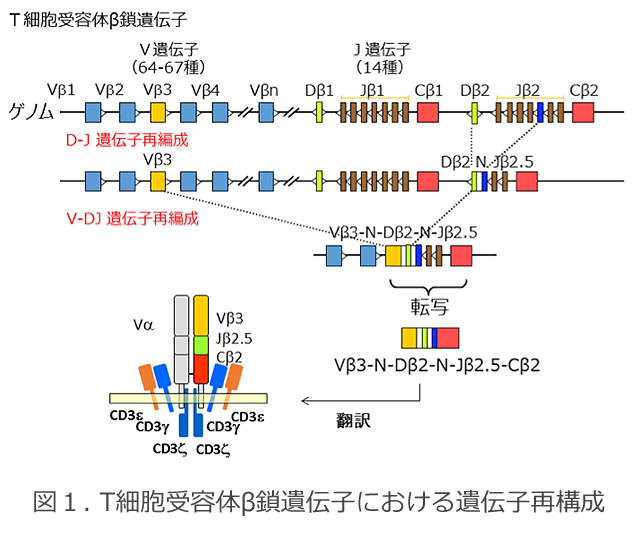
TCR遺伝子構造
TCR遺伝子は免疫グロブリン遺伝子と同様に、ゲノム上では多数のV (variable)、D (diversity)、J (joining)およびC (constant) の遺伝子断片からなります(図1)。T細胞の分化、成熟の過程で遺伝子再構成が行なわれ、β鎖遺伝子では、DとJのそれぞれ1つずつがランダムに選ばれて結合します。続いて、V-DJ間で遺伝子再構成が起こります。その過程で、V-D間およびD-J間にランダムに塩基の挿入や欠失が起こり(N領域)、遺伝子の多様性が高まります。メッセンジャーRNA前駆体で、VDJ領域と共通領域であるC領域でRNAスプライシングが起こり、機能的TCR遺伝子として発現されます。
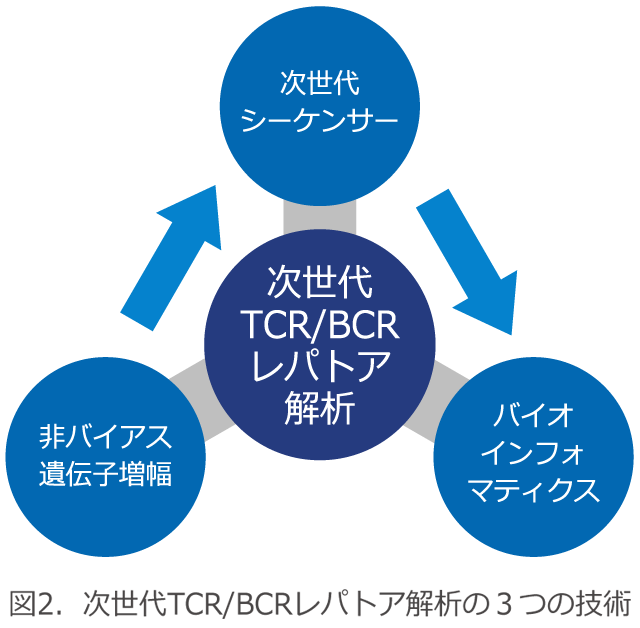
次世代TCR/BCRレパトア解析の3つの技術
当社の次世代TCRレパトア解析は、ロングリードシーケンス、非バイアス遺伝子増幅技術、専用バイオインフォマティクスソフトの3つの技術から成り立っています(図2)。TCRレパトア解析では、V、D、J、Cの各領域をアサインメントするため、400-600bpのロングリードのシーケンスが必要です。次世代シーケンス(Next-generation Sequencing, NGS)は大量の塩基配列決定が可能ですが、解析塩基長が短いという欠点がありました。そのため、ロングリードシーケンスが可能なMiSeq (illumina)を採用しています。また、多数の遺伝子断片からなるすべてのTCR遺伝子を均一に増幅する必要があります。当社では、1セットのプライマーですべてのTCR遺伝子を増幅するAdaptor-ligation PCR(AL-PCR)法を採用し、原理的にPCRバイアスが生じない設計がなされています。同時に、NGSに対応したバイオインフォマティクスソフト(Repertoire Genesis)を独自に開発し、大量のリードを高速、高精度に解析することができます。
これらの技術を統合し、定量的かつ網羅的に大規模なレパトアを解析できる「次世代TCR/BCRレパトア解析」が完成しました。
非バイアス遺伝子増幅
TCR/BCRレパトア解析では、最も重要な情報を持つ相補性決定領域3(Complementarity-determining region 3: CDR3)の配列を決定することが必要です。ゲノムDNAから遺伝子増幅する場合、C領域にプライマーを設定できないため、5’側のV領域と3’側のJ領域に設計した複数のPrimerを用いて増幅するMultiplex PCR法が多く用いられます。この場合、Primer間の増幅効率の差や類似配列へのミスプライミングなどによりPCR反応の間にバイアスを生じることになります。RNAを材料に用いた場合、C領域特異的Primerを使用できますが、多数のV特異的プライマーが必要になります。
そこで当社では、RNAから合成した二本鎖DNAの5’末端にアダプターを付加して、アダプタープライマーとC領域特異的primerを用いて増幅するAL-PCR法を用いています(図3)。この方法では、異なるVやJ領域を持つすべてのTCR遺伝子を、1セットのプライマーで増幅することが可能です。Multiplex PCR法で問題となるPCRバイアスは起こりません。
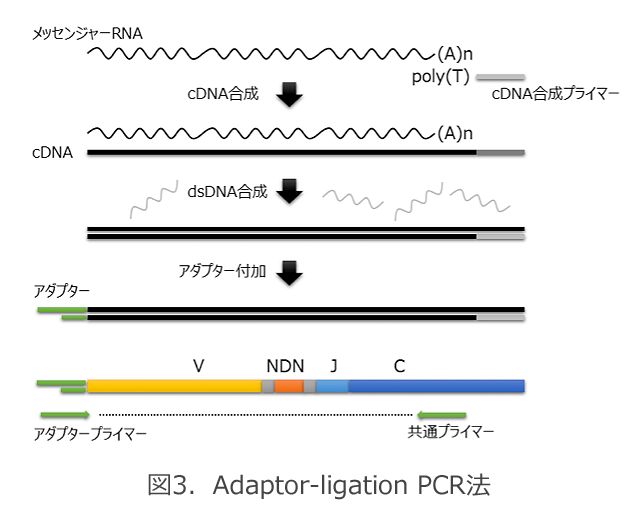
トータルRNAよりpoly(T)プライマーを利用して逆転写酵素反応により相補的DNA(cDNA)を合成します。続いて、cDNAを鋳型にして複数の酵素を用いて二本鎖DNA(dsDNA)を合成します。dsDNAの5’末端にPCRプライマーとしても働く二本鎖アダプターをLigation反応により付加します。アダプタープライマーと共通領域であるC領域に設定したC領域特異的プライマーでPCRを行ないます。
バイオインフォマティクス
NGSにより得られた膨大な遺伝子データについて、リファレンス配列との相同性解析を行い、各V、D、J、Cのアサインメントが必要になります。公的データベースでは、High-VQUEST (the international ImMunoGeneTics information system®: IMGT、フランス) や、IgBLAST (National Center for Biotechnology Information: NCBI、アメリカ) などのプログラムが提供されています。当社では、NGSに対応した独自のTCR/BCRレパトア解析専用のバイオインフォマティクスソフトとしてRepertoire Genesisを開発しました。このソフトウェアは高精度な各V、D、J、C配列のアサインメントとともに、アミノ酸配列変換、CDR3配列の抽出、リード集計などの解析を高速に行なうことができます。また、多様な集計結果やグラフの出力が可能で、ユーザビリティが高い仕様になっています。専用サーバー内で運用することで、セキュリティや解析速度も向上させています。
解析結果事例
2Dグラフ、3Dグラフ
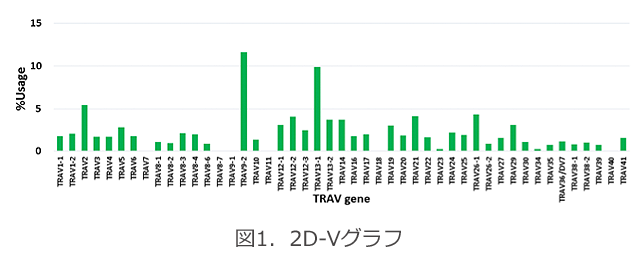
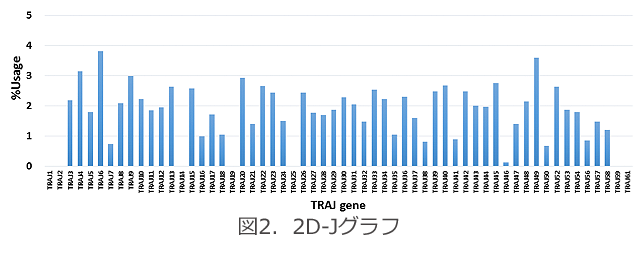
次世代TCR/BCRレパトア解析では大規模な配列データを用いることで高解像度な描写が可能になりました。
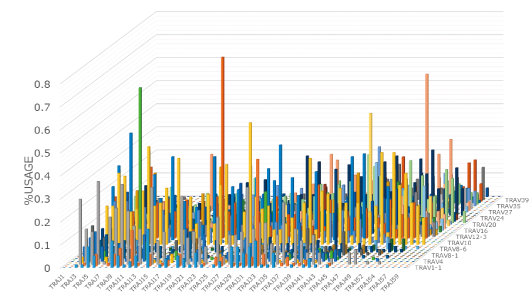
2Dグラフ(図1および図2)は、試料中に存在するTCRについて、各V遺伝子やJ遺伝子をどのくらい使用されているかを頻度(%)で示しています。対照試料との間で、使用頻度を比較することができ、増減や異常値を見つけることができます。
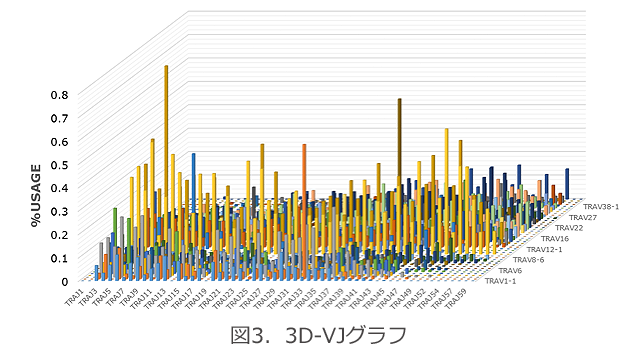
3D-VJグラフは、TCRにおける各VJ遺伝子の組み合わせを持つTCRの頻度(%)を示しています(図3)。より詳細に、かつ俯瞰的に全体のレパトアを見ることができます。特定のVJ遺伝子の増加から、クローナリティの変化を検出することもできます。
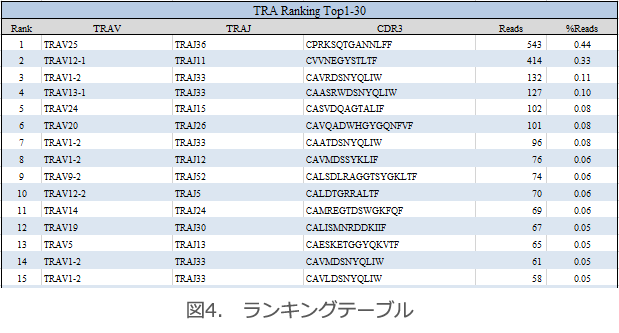
ランキングテーブル
ランキングテーブルは、試料中に存在するTCRのユニークリードについて、コピー数順でランキングしたものです(図4)。各TCRリードのV、J、CDR3配列、フレーム、リード数、頻度(%)が示されます。クローナリティの高い検体では、少数の高コピーのリードが検出されます。CDR3の配列を利用し、TCRクローンの出現や増減など微少な変化を調べることができます。
二次データ解析
当社では、TCR/BCRレパトア一次解析データを元に統計解析やグラフ作成などを行う二次データ解析をオプションサービスとして提供しています。以下に事例をご紹介いたします。
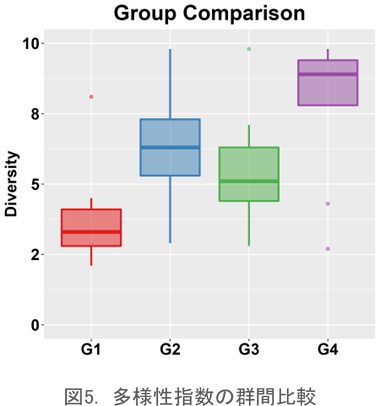
群間比較
レパトア多様性指数を群(比較したい集団)毎に箱ひげ図でプロットしたものです。データの範囲や中央値、外れ値の有無がわかりやすく、多様性指数を用いた比較で最もよく使われる評価方法の一つです。
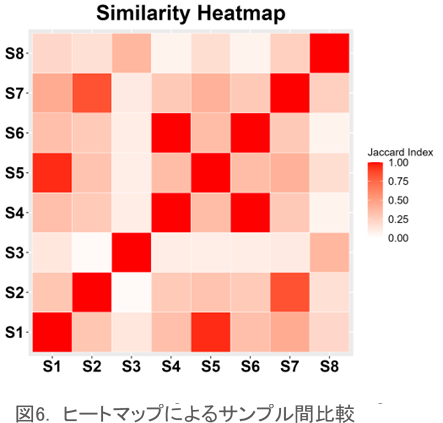
ヒートマップによるサンプル間比較
サンプル間のレパトア類似性を示すJaccard(ジャッカード)指数をヒートマップで視覚化したものです。どのサンプル間のレパトアが最も類似しているかをわかりやすく表示できます。
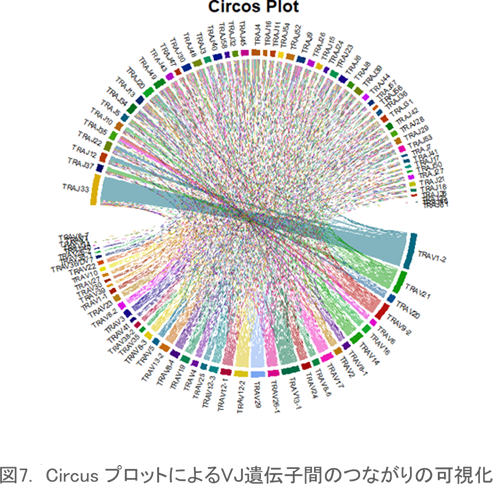
Circos プロット
レパトアデータを円形のレイアウトで表示するcircos(サーコス)プロットはVJ遺伝子の関連を視覚化する際によく利用されます。それぞれのリンクは特定のVJ遺伝子の組み合わせとその存在頻度を示し、より太いリンクは存在頻度の高さを示しています。
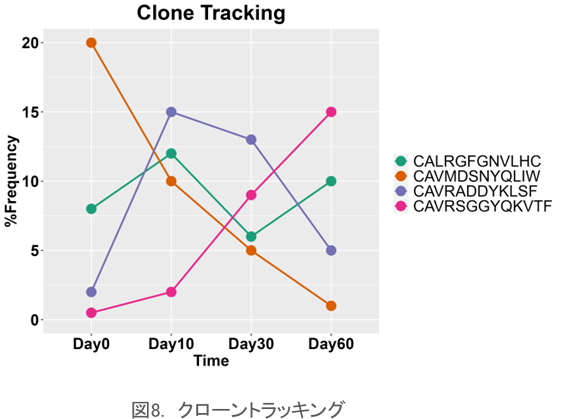
クローントラッキング
特定のクローンの存在頻度を時系列にプロットします。CDR3配列で特定された個々のクローンの変動を調べ、外部刺激に対するレパトアの応答を検知できる可能性があります。
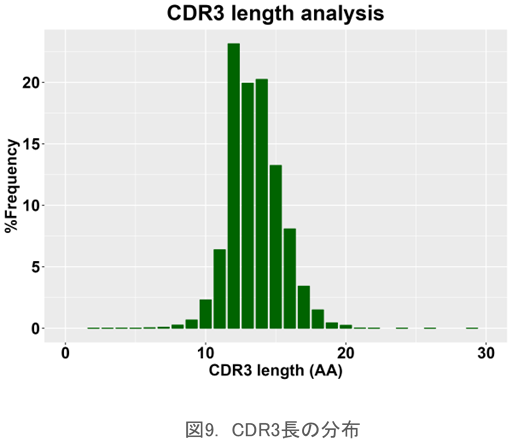
CDR3長解析
CDR3領域のアミノ酸配列の長さの分布をプロットします。通常、正規分布様のパターンになりますが、特定のクローンが増加した場合はピークの変化が見られます。検体毎のレパトアの特徴を評価する際に用いられます。
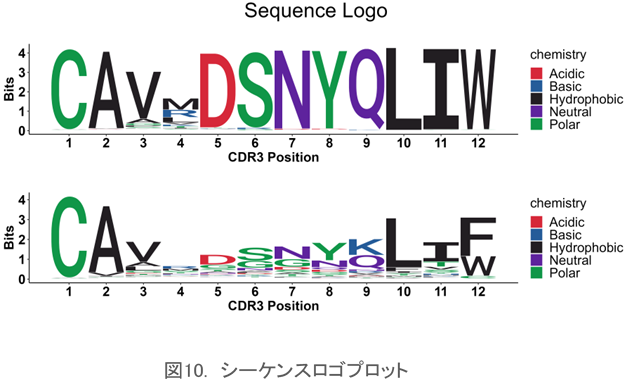
シーケンスロゴプロット
CDR3領域のアミノ酸配列のパターンを視覚的にわかりやすく表示します。クローン間や検体間で共通のアミノ酸モチーフを見つけるのに用いられます。
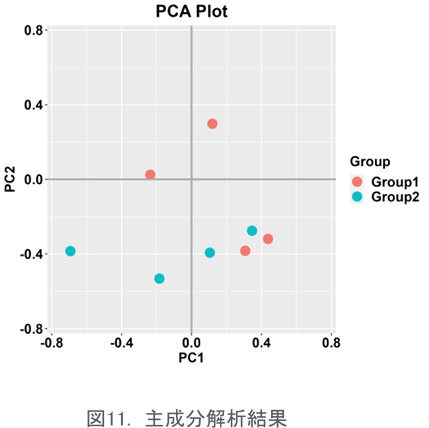
主成分解析
多変量解析の一手法で、オブジェクト間の類似性を2次元のチャートで表現する手法です。検体間の関係を点の布置で表現する手法で、似たものは近くに、異なったものは遠くに配置されます。検体間のレパトアの違いあるいは類似度をグラフィカルに表現する際に用いられます。
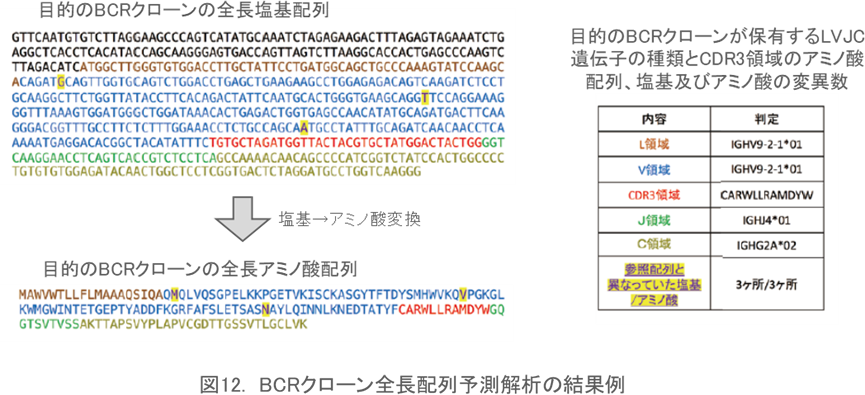
全長配列予測解析
特定のクローンについて、Fastqデータ(塩基配列データ)を再解析することでTCRおよびBCR遺伝子のV領域からC領域までの全長配列を予測します。クローンの全長塩基およびアミノ酸配列に加え、データベース上の参照配列と一致しない塩基およびアミノ酸変異を明らかにします(図12)。作成したハイブリドーマが産生する抗体の全長配列を知りたい時や、疾患特異的なTCRクローンの全長配列を知りたい時などに用いられます。
レパトア解析の歴史
1976年利根川進博士による免疫グロブリンの遺伝子再構成のメカニズムの発見の後、同じような遺伝子構造を持つT細胞受容体(TCR)の遺伝子構造や機能の解明が進みました。世界中の研究者によって、無数の抗原に対応できる多様な受容体がどのように形成されるか、自己と非自己をどのように識別し、非自己をどう排除するかなど、免疫学の重要な課題が次々と明らかにされていった時期でした。
1980年代に入ると、cDNAクローニングなどの遺伝子工学技術が広く利用され、競って新しいTCR遺伝子V領域やJ領域の配列が明らかにされていきました。当時、塩野義製薬の鈴木隆二(Ryuji Suzuki)は、MDアンダーソン癌研究センターで腫瘍免疫に関する研究を行なう中、特異的免疫応答の研究にはT細胞の特異性や多様性を解析できる新しいツールが必要であると考え、帰国後TCRレパトア解析の研究グループを立ち上げたのです。
そのころ、画期的な技術としてPCR法が急速に普及し、TCR遺伝子のクローニングと配列決定が進められていきました。TCR遺伝子は5’側に位置するV領域が多様性に富むため、5’RACE法、Inverse PCR法やAnchored PCR法などの特殊な方法が用いられました。鶴田(Tsuruta)らの研究グループは、TCR遺伝子の二本鎖DNAの5’末端にadaptorを付加して、adaptor-primerと共通領域(C領域)に設定したprimerを用いて増幅するAdaptor-ligation PCR(AL-PCR)法を開発し、αβTCRやγδTCRの解析系を確立しました(1,2)。現在、PCRバイアスを引き起こす複数のprimerを用いたMultiplex PCR法が多く利用されていますが、AL-PCR法はすべてのTCR遺伝子を非バイアスで増幅できるため、正確な定量解析が可能でした。研究グループは、その技術を利用してTCR遺伝子の定量法の開発に取り組み、V領域特異的オリゴプローブと化学発光法を利用したReverse Dot Blot(RDB)法(3)や96ウェルプレートで簡便に定量できるMicroplate Hybridization Assay (MHA) 法(4)の開発に成功しました。これら定量法は、V鎖特異的抗体が十分に入手されていないフローサイトメトリー(FACS)法に代わり、TCRレパトアを網羅的に解析する有用なツールとして、さまざまな分野の基礎研究や疾患関連研究に大いに役立てられました。
TCRの特異性や多様性は、抗原認識部位である相補性決定領域3(CDR3)に大きく依存しています。β鎖はV-DあるいはD-J間に、α鎖はV-J間にランダムに塩基の挿入や欠失が起こるため、個々のTCRは異なる長さのCDR3配列を持つことになります。その特徴を利用して、ゲル電気泳動でCDR3塩基配列長の分布を調べるCDR3 Size Spectratyping法が広く利用されています。しかしながら、FACS解析、V遺伝子の定量解析やCDR3鎖長解析のいずれの方法でも、特異性に最も重要な情報であるCDR3配列を決定することができません。そのため、PCRクローニングや小規模なシーケンス解析が行なわれましたが、その中で登場したのが、illumina、Roche454、Ion Torrentシーケンサーなどの次世代シーケンス解析装置(Next generation sequencing, NGS)です。NGSを利用することで大規模なTCR遺伝子の配列決定が可能になり、これまでとは次元の異なる大量のデータから、特異性や多様性に関する配列情報を明らかにすることができるようになりました。海外では、NGSを使ったレパトア解析サービスを提供する企業が設立され、主にMultiplex PCR法を用いた方法が採用されています。当社では、その欠点を克服するため、非バイアス遺伝子増幅技術であるAL-PCR法を採用した次世代TCR/BCRレパトア解析法の開発を進め、ほかの技術と比較して格段に定量性に優れ、信頼性の高い技術を確立しました。
バイオインフォマティクスでは、創業者の一人であるビッツ(株)代表取締役の新井(Shin-I)が大規模なシーケンスデータから高速、高精度にレパトアを解析するレパトア解析専用ソフト(Repertoire Genesis)を開発しました。TCR遺伝子のV、D、J配列は多数の類似配列からなり、得られた個々の配列をリファレンス配列と高速に照合し、集計できるバイオインフォマティクスソフトが必要でした。このソフトの利用により、公的データベースやプログラムに依存しない、高速、高精度なレパトア解析が可能になりました。2Dあるいは3Dのグラフィック機能やクローン配列のランキング機能が加わり、高解像度かつ表現力の高いレパトアを描出することができます。
2014年、これまでのTCR解析研究で培った技術と経験を活かして、NGSという最新の技術を取り入れることで、非バイアス遺伝子増幅技術とオリジナルバイオインフォマティクスソフトを統合した次世代型TCR/BCRレパトア解析を日本国内で初めて提供することができました。
1) Tsuruta Y, et al. J Immunol Methods. 1993, 161(1):7-21.
2) Tsuruta Y et al. J Immunol Methods. 1994, 169(1):17-23.
3) Yoshioka T, et al. J Immunol Methods. 1997, 201(2):145-55.
4) Matsutani T, et al. Hum Immunol. 1997, 56(1-2):57-69.
レパトア解析の利用例
腫瘍免疫への利用
免疫系の抗腫瘍効果を治療に利用する免疫チェックポイント阻害薬やがん免疫療法においては、抗腫瘍効果を発揮するエフェクターT細胞を直接検出することが重要です。細胞傷害性Tリンパ球(CTL)アッセイやELISPOT法などで、がん病変部組織で腫瘍浸潤T細胞(TIL)を直接評価することは容易ではありません。次世代TCRレパトア解析により、TILの質的、量的な変化を調べ、免疫チェックポイント阻害薬やがん免疫療法の有効性評価を行なうことができます。
白血病や悪性リンパ腫の検出
次世代TCR/BCRレパトア解析は、T細胞またはB細胞のクローナリティーを高感度で測定することができ、白血病や悪性リンパ腫の検出に有用です。従来、サザンブロット法やPCR法でクローナルT細胞やB細胞の検出が行なわれてきました。次世代TCR/BCRレパトア解析では、高感度検出が可能であるとともに、TCRやBCRの塩基配列にもとづいて腫瘍細胞を同定できる利点があります。その特長をいかし、治療後の微少残存病変の検出にも利用できます。治療前に腫瘍細胞のTCRまたはBCRを同定すれば、その塩基配列を使って微少残存病変を高感度に検出することができます。
骨髄移植後の免疫多様性回復
次世代TCR/BCRレパトア解析は免疫系の多様性を評価する指標としても有用です。骨髄移植などの移植医療において、移植後の免疫機能の回復が問題になります。移植後の幹細胞から分化したT細胞やB細胞の多様性の回復が、感染症予後にとって重要です。次世代TCR/BCRレパトア解析を用いて、クローンレベルのT細胞やB細胞の多様性を評価することができます。
抗原特異的T細胞の探索とトラッキング
特定の抗原で誘導される抗原特異的T細胞を探索することができます。対照試料と比較して、あるいは抗原刺激の前後の試料を解析することで、抗原刺激により変化したT細胞=抗原特異的T細胞を探索することができます。また、抗原刺激した複数の個体で重複するTCRを探索することでも、抗原特異的T細胞を探索することができます。
自己免疫疾患のバイオマーカー
多くの自己免疫疾患の原因は十分に明らかにされておらず、様々な免疫系の異常により発症すると考えられています。TCR/BCRレパトア解析により、自己免疫疾患に特徴的なT細胞やB細胞の異常が明らかになれば、それらをバイオマーカーとして利用することができます。また、同一の症状を呈する患者さんの中でも、特定のT細胞の異常に起因する患者さんや、抗体を産生するB細胞の異常が原因となる患者さんを適切に層別化(サブグループ化)することができればそれらの患者さんに対するより効果的な治療法を開発することが可能になります。
感染免疫
ウイルス感染前後の試料を解析することで、ウイルス抗原特異的T細胞を同定することができます。抗原特異的T細胞を同定すれば、クローントラッキングすることができます。
先端的治療への応用
次世代レパトア解析技術を用いて取得されたTCR/BCRの遺伝子情報から、さまざまな治療薬や治療法の開発につなげることができます。
TCR遺伝子治療
がんペプチドワクチンやがん抗原で刺激した試料のTCRレパトア解析から、抗原特異的TCRを取得することができます。得られたTCR遺伝子を、既存の遺伝子導入技術を用いて患者リンパ球に導入し、患者体内へ戻すことで効果的なTCR遺伝子治療を行うことができます。
抗体医薬の創製
次世代BCRレパトア解析により抗原特異的BCRの全長配列を取得すれば、ハイブリドーマ細胞の取得やスクリーニングを必要とすることなく、直接ヒト型抗体を作成できます。BCRでは遺伝子再構成後に体細胞超突然変異が起こります。そのため、Multiplex PCR法では、プライマーのミスプライミングが起こり、正確な定量解析が困難になります。AL-PCR法により正確なBCRレパトアの解析が可能で、効率的な抗体遺伝子の取得が可能になると期待されます。
CAR-T療法
近年、抗体の抗原結合領域と、TCRのシグナル伝達領域を結合させたキメラ抗原受容体(Chimeric antigen receptor:CAR)による治療が注目されています。次世代BCRレパトア解析によるがん抗原特異的抗体遺伝子のスクリーニングが進むことで、より効果的な治療用遺伝子を取得することが期待されます。
 受託サービスサイトへ
受託サービスサイトへ